Mehr erfahren
Leben mit Transfusion: Tipps für Patienten und Angehörige (Herausgeber: Novartis).
Download als PDFJede MDS-Erkrankung hat ihre eigene Ausprägung und zeigt einen sehr individuellen Verlauf. Patienten unterscheiden sich auch in der Art der Begleiterkrankungen und ihrem Alter. Zusammen mit den verschiedenen krankheitsspezifischen und persönlichen Merkmalen des Patienten entsteht ein spezifisches Krankheitsprofil, welches in der Zusammenschau letztendlich wegweisend für eine personalisierte Therapieentscheidung bei jedem Patienten sein sollte.
So unterschiedlich Patienten und ihre MDS-Erkrankung sind, so unterschiedlich sind heute auch die Behandlungsmöglichkeiten.
Je nach Erkrankungstyp wird eine individuelle Behandlungsform für den Patienten gewählt. Diese können variieren, miteinander kombiniert und im Krankheitsverlauf verändert werden. In Deutschland sind Azacitidin, Lenalidomid, Deferasirox, Luspatercept und Epoetin alfa für die Therapie von bestimmten Patienten mit MDS zugelassen. Im klinischen Alltag haben sich zahlreiche weitere Medikamente bewährt. Als Erstes sollte der behandelnde Arzt gemeinsam mit dem Patienten und seinen Angehörigen darüber sprechen, ob eine Behandlung erforderlich ist und wenn ja, welches Behandlungsziel besteht.
Eine Heilung ist nur durch eine allogene Stammzelltransplantation möglich. Diese ist jedoch nicht bei allen MDS-Patienten durchführbar oder sinnvoll und nötig. Individuelle Behandlungspläne werden aufgrund des MDS-Typs des Patienten, seines Alters und seines allgemeinen Gesundheitszustands ausgewählt. Bei der Therapieplanung werden außerdem Begleiterkrankungen und die persönliche Einstellung des Patienten zum therapeutischen Risiko berücksichtigt. Viele Therapiestrategien beim MDS dienen der Verbesserung der Lebensqualität bzw. der Linderung von Symptomen. Darüber hinaus befinden sich einige Medikamente gegenwärtig in der Phase der klinischen Entwicklung. Sie werden möglicherweise in den nächsten Jahren zur Behandlung zugelassen.
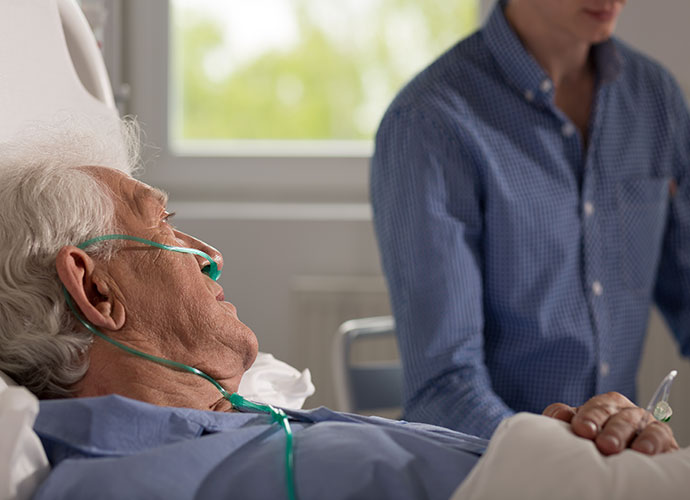

Der Ansatz mit der Abkürzung BSC hat das Ziel die Lebensqualität der Patienten zu verbessern. Er nennt sich bestmögliche unterstützende Behandlung (BSC: Best Supportive Care). Im Mittelpunkt steht die Symptombehandlung und keine ursächliche Therapie. So geht es Patienten bspw. besser, wenn sie Bluttransfusionen erhalten. Bei einem Infekt werden z.B. Antibiotika eingesetzt. Außerdem verschreiben die Ärzte ggf. Präparate, um das überschüssige Eisen, das den Patienten durch die Transfusionen zugeführt wird, wieder zu entfernen. Eine Impfung gegen Pneumokokken, Grippeviren und Covid-19 ist bei Patienten mit MDS empfehlenswert. MDS-Patienten sollten unbedingt darauf achten, dass alle Ärzte oder Zahnärzte, in deren Behandlung sie sich befinden, über die Knochenmarkerkrankung Bescheid wissen.
Wo es heute bereits möglich ist, werden die Ärzte die Risiken sorgfältig abwägen und alles daran setzen, auch heilende Verfahren anzuwenden.
MDS-Erkrankungen verschlechtern sich häufig sehr langsam. Für Betroffene im Frühstadium einer MDS-Erkrankung kann „Abwarten und Kontrollieren“ die beste Strategie sein. Dies kann auch dann der Fall sein, wenn nur geringe Beschwerden bzw. schwache Symptome vorliegen und der Patient trotz der Erkrankung weiterhin eine gute Lebensqualität hat.
Die Erkrankung wird bei "Abwarten und Kontrollieren" nicht aktiv durch ein Medikament behandelt. Jedoch sollten Patienten regelmäßig zu ihrem Arzt gehen und Blutbildkontrollen durchführen lassen, um sicher zu sein, dass sich ihre Erkrankung nicht unbemerkt – eben schleichend – verschlechtert.


Ziel einer Bluttransfusion ist es den Hämoglobinwert oder die Blutplättchenkonzentration anzuheben, um damit die Sauerstoffaufnahme zu verbessern bzw. die Blutungsneigung zu verringern. Die Durchführung von Bluttransfusionen ist heute sehr sicher.
Bei Anämie werden rote Blutkörperchen als Erythrozytenkonzentrat (EK-Gabe) intravenös gegeben. Transfusionsbedürftige MDS-Patienten erhalten i. d. R. ambulant in unterschiedlichen, individuell festzulegenden Abständen ein bis zwei Erythrozytenkonzentrate.
Weisen die Patienten eine erhöhte Blutungsneigung auf, werden Blutplättchen als Thrombozytenkonzentrat intravenös verabreicht. Diese Transfusion wird ebenfalls ambulant in einer Arztpraxis, Spezialambulanz oder Klinik durchgeführt.
Wenn viele Transfusionen über einen langen Zeitraum gegeben werden, können Immunreaktionen auftreten. Die körpereigene Abwehr der Patienten entfernt die fremden menschlichen Zellen im Blut dann schneller, als es nötig wäre. Die Patienten brauchen in der Folge mehr Transfusionen.
Bei regelmäßigen Gaben von roten Blutzellen kann es zu einer Eisenüberladung kommen. Der Überschuss an Eisen schädigt Organe wie das Herz und die Leber. Deshalb verordnen Ärzte in diesem Fall ein weiteres Medikament, welches das Eisen bindet und aus dem Körper abführt (Eisenchelatbildner).
Leben mit Transfusion: Tipps für Patienten und Angehörige (Herausgeber: Novartis).
Download als PDF3 – 8 Tage
Lebensdauer eines Blutplättchen
120 Tage
Lebensdauer einer roten Blutzelle
Bei Transfusion 5 und 60 Tage
Lebensdauer, da eine Mischung von alten und neuen Zellen übertragen wird
Für die verschiedenen Erscheinungsformen und Risikogruppen der MDS-Erkrankungen gibt es mittlerweile ein Reihe von Medikamenten. Nachdem Ihre Erkrankung in die Gruppe „Niedrigrisiko“ oder „Hochrisiko“ eingeteilt wurde, wird Ihr behandelnder Arzt eine individuelle Therapiestrategie für Sie festlegen. Vor Therapiebeginn empfehlen wir jedem Patienten eine Beratung und ggf. Vorstellung in einem Zentrum der D-MDS.

Bei einer Therapie mit bestimmten Botenstoffen (Zytokinen) werden im Labor produzierte Stoffe verwendet, die die Blutbildung oder das Immunsystem günstig beeinflussen. Diese Stoffe kommen auch natürlicherweise im Körper vor und gelten daher als „biologisch“. Beispiele für solche Therapien sind Blutzellen-Wachstumsfaktoren wie Erythropo- etin (kurz: „EPO“) oder G-CSF (Granulozyten-Kolonie stimulierender Faktor). Diese Wachstumsfaktoren steuern die Produktion von Blutzellen und haben in klinischen Untersuchungen gezeigt, dass sie das Knochenmark des Patienten anregen, gesunde Blutkörperchen zu produzieren.
MDS-Patienten, bei denen eine Blutarmut vorliegt, sollten mit Epoetin alfa, einem bestimmten Erythropoetin, behandelt werden, wenn der Erythropoetinspiegel vor Beginn der Behandlung unter 200 Milli-Units pro Milliliter liegt. Dann ist eine Verbesserung der Hämoglobin-Werte durch von außen zugeführtes Erythropoetin zu erwarten. Liegt der Erythropoetin-Spiegel über 500 Milli-Units pro Milliliter, sollte Erythropoetin nicht eingesetzt werden, da ein Ansprechen nicht zu erwarten ist. An Nebenwirkungen können u.a. Kopfschmerzen, Gelenkbeschwerden oder grippeähnliche Symptome auftreten.

Das immunmodulatorische Medikament Lenalidomid kann bei einem Teil der Patienten mit Niedrigrisiko-MDS und teilweisem oder vollständigem Verlust des langen Arms des Chromosoms 5 [Deletion 5q; kurz: del(5q)] durchgreifende Erfolge erzielen. Bei ca. 2/3 dieser Patienten kann ein normales Blutbild erreicht werden. Transfusionen können dann, zumindest für einige Zeit, ausgesetzt werden. Lenalidomid ist für MDS-Patienten mit ausschließlich der genannten Veränderung am Chromosom 5 in Deutschland zugelassen.
Die Behandlung ist als Dauertherapie angelegt. Meistens verbessert sich das Blutbild innerhalb von zwölf Wochen. Als Nebenwirkung kann es zu einer Verminderung der weißen Blutkörperchen und der Blutplättchen kommen.

Transfusionsbedürftige Patienten mit Niedrigrisiko-MDS und Ringsideroblasten, die auf Erythropoetin nicht angesprochen haben, das Ansprechen auf Erythropoetin verloren haben oder für eine Erythropoetin-Therapie nicht infrage kommen, weil der Spiegel des körpereigenen Erythropoietins zu hoch liegt, können mit Luspatercept behandelt werden. Diese Substanz beschleunigt die Ausreifung der Bildung von Erythrozyten im Knochenmark und kann zu einem Anstieg der Hämoglobin-Werte und auch zu Transfusionsfreiheit führen. Das Medikament wird alle drei Wochen in die Bauchhaut gespritzt und ist im Allgemeinen gut verträglich. Einige Patienten klagen über ausgeprägte Müdigkeit als Nebenwirkung.

Die Therapie mit Azacitidin ist in Deutschland für die Behandlung von Patienten mit Hochrisiko-MDS zugelassen. Das Medikament wird an sieben Tagen hintereinander in einem vierwöchentlichen Intervall unter die Haut gespritzt. Die Behandlung ist als Dauertherapie angelegt. Etwa die Hälfte der Patienten spricht an. Azacitidin kann die Erkrankung nicht heilen, führt aber zu einer Lebensverlängerung.
Die häufigsten Nebenwirkungen von Azacitidin bestehen in Magen-Darm-Beschwerden, zum Teil langanhaltenden Verminderungen der Blutzellen mit erhöhtem Transfusionsbedarf und Nierenfunktionsstörungen. Außerdem kommen bei der Therapie mit Azacitidin häufig lokale Reizungen an der Einstichstelle vor. Mit Salben und Cremes können die Beschwerden abgemildert werden. Nach Beendigung der Therapie bilden sich die Entzündungen wieder zurück.
Ein Ansprechen auf die Therapie ist in der Regel erst nach mehreren Therapiezyklen, also nach mehreren Monaten, zu erwarten. Heutzutage wird die Azacitidine Therapie häufig mit einer Tablettentherapie mit dem Namen Venetoclax kombiniert, hierbei erzielen die Patienten ein häufigerer und schnelleres Therapieansprechen.

Die allogene Stammzelltransplantation von einem verwandten oder unverwandten Spender ist die Therapie der Wahl für jüngere Patienten mit Hochrisiko-MDS und stellt gegenwärtig die einzige Therapiemöglichkeit mit der Chance auf eine langfristige Heilung der Erkrankung dar.
Bei einer allogenen Stammzelltransplantation wird mit hochdosierter Chemotherapie, ggf. in Kombination mit Strahlentherapie, das Knochenmark zerstört (Konditionierung). Es folgt dann die Übertragung von gesundem Knochenmark oder Blutstammzellen von einer anderen Person, um das zerstörte blutbildende System zu ersetzen. Als Spender kommen Angehörige oder nichtverwandte Personen infrage, deren Gewebemerkmale denjenigen des Stammzellempfängers gleichen oder sehr stark ähneln. Hinsichtlich der Therapieergebnisse macht es heutzutage keinen wesentlichen Unterschied mehr, ob der Spender verwandt oder unverwandt ist.
Generell sollte die Stammzelltransplantation bei jedem Patienten mit MDS und gutem Allgemeinzustand – auch im höheren Lebensalter – in die Therapieüberlegungen einfließen. Frühzeitig angestrebt werden sollte sie, wenn die Betroffenen noch jung sind und sehr niedrige Blutwerte oder einen stark ansteigenden Transfusionsbedarf haben. Neben den MDS-typischen Prognosefaktoren, wie ungünstigen Chromosomen-Veränderungen oder einem erhöhten Blastenanteil, sind vor allem relevante Begleiterkrankungen des Herzens oder anderer Organe zu bedenken.
Die Studienzentren der Deutschen MDS-Studiengruppe (D-MDS) führen für MDS-Patienten aller Risiko-Gruppen klinische Studien durch, welche den Einsatz von neuen, sehr vielversprechenden Medikamenten beim MDS untersuchen. Bis zur Zulassung weiterer, neuer Medikamente stellen die innerhalb solcher Studien durchgeführten Therapien unter Umständen die beste Möglichkeit für eine erfolgversprechende Behandlung dar.
Informationen zu aktuellen Studien für Patienten mit MDS finden sie in unserem MDS Studienfinder.